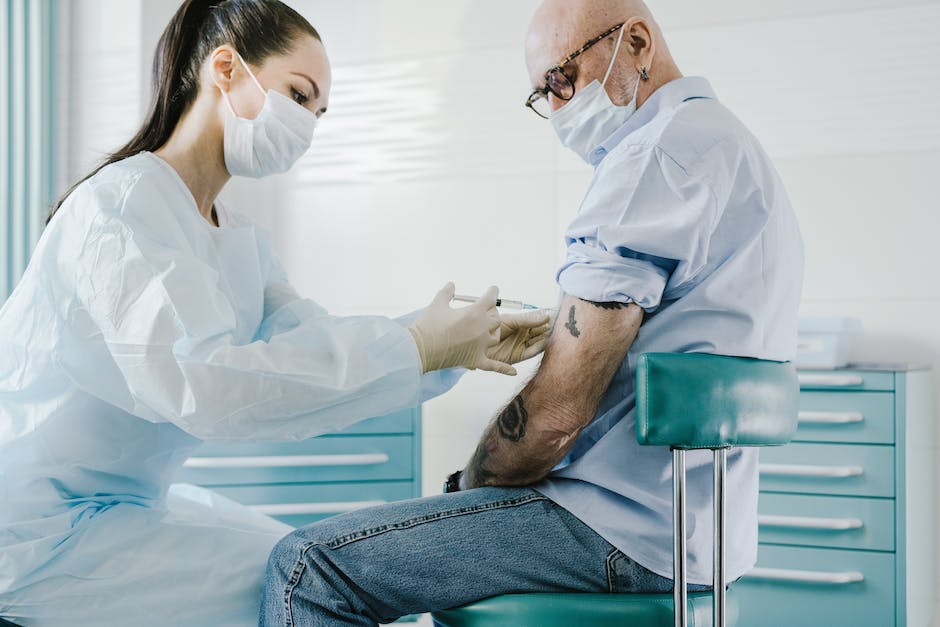
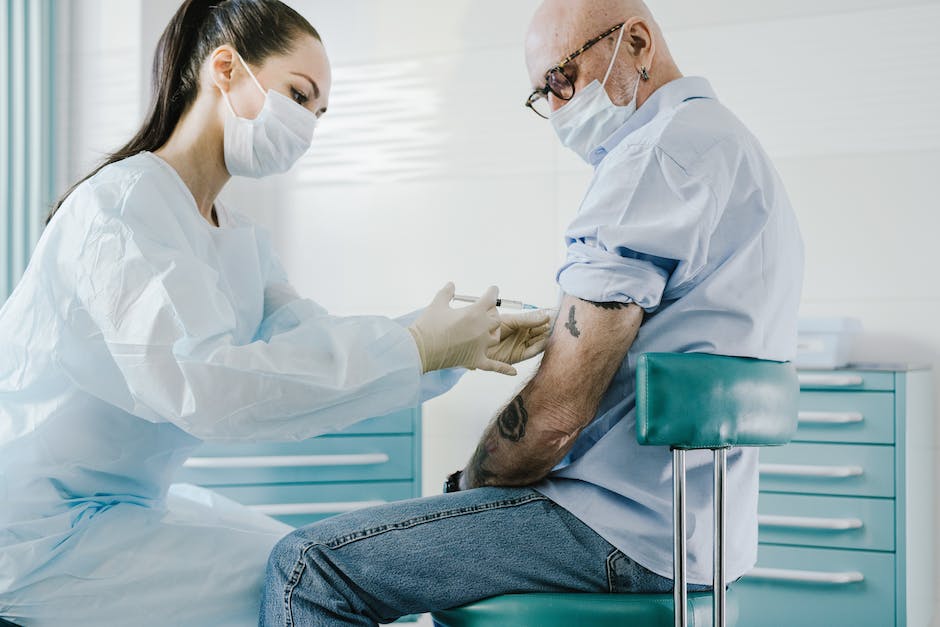
Hallo liebe Leser!
Heute möchte ich euch einmal erklären, wie lange klinische Studien für Impfstoffe dauern. Dabei werde ich auf die verschiedenen Phasen eingehen, die dazu notwendig sind, um einen Impfstoff zu entwickeln. Ich hoffe, dass dir meine Erklärungen weiterhelfen und du nachher mehr über die Entwicklung von Impfstoffen weißt. Also, lasst uns loslegen!
Klinische Studien zur Entwicklung eines Impfstoffs können je nach Komplexität und Art des Impfstoffs unterschiedlich lange dauern. In der Regel dauert die Entwicklung eines Impfstoffs, vom Beginn der Forschung bis zur Zulassung, etwa zehn Jahre. Dieser Zeitrahmen kann jedoch aufgrund der Komplexität oder der Art des Impfstoffs variieren.
Phase I-IV Medikamentenstudien: Sicherheit und Wirksamkeit
Phase I-Studien dienen dazu, die Sicherheit und Dosierung eines neuen Medikaments zu bewerten. Dabei wird eine sehr kleine Anzahl von gesunden Freiwilligen untersucht. Phase II-Studien werden durchgeführt, um die Wirksamkeit eines Medikaments zu bewerten. Dabei nehmen mehr Patienten teil und die Studien dauern länger als Phase I-Studien. Phase III-Studien sind die größten und aufwendigsten Studien, die dazu dienen, die Wirksamkeit eines Medikaments in einer größeren Gruppe von Patienten zu bestimmen. Sie dauern mehrere Monate oder sogar Jahre und beinhalten oft Tausende von Freiwilligen. Mit Phase IV-Studien wird die Sicherheit und Wirksamkeit des Medikaments nach dessen Zulassung über einen längeren Zeitraum beobachtet. Dabei wird geprüft, wie das Medikament in der breiten Bevölkerung angenommen und vertragen wird. Diese Studien können Monate oder sogar Jahre andauern.
Klinische Prüfung: 6 Jahre oder schneller für neue Medikamente
Hast du schon mal was von der klinischen Prüfung gehört? Es handelt sich dabei um einen Prozess, der die Sicherheit und Wirksamkeit eines neuen Arzneimittels überprüft. Dieser Prozess dauert normalerweise sechs Jahre, von Phase I bis Phase III, doch in bestimmten Situationen kann er auch schneller vonstattengehen. Zum Beispiel bei einer Pandemie wie der Corona-Pandemie, wo viele neue Medikamente und Impfstoffe in kürzerem Zeitrahmen entwickelt werden müssen. Einige neue Medikamente, die zur Behandlung von COVID-19 entwickelt werden, sind bereits in Phase III der klinischen Prüfung.
Medikamententwicklung: Mehr als 5 Jahre bis zur Markteinführung
Es dauert oft länger als fünf Jahre, bis ein Medikament von Beginn des Projekts bis zum Abschluss der präklinischen Tests auf den Markt kommt. Dieser Prozess ist sehr komplex und umfasst mehrere Phasen. Zunächst muss das Medikament an Tieren getestet werden, um zu sehen, ob es sicher und wirksam ist. Anschließend wird es an Freiwilligen getestet, um zu beurteilen, wie es beim Menschen wirkt. Erst nachdem alle Tests abgeschlossen sind, wird das Medikament vom Gesundheitsministerium genehmigt und kann auf den Markt gebracht werden. So dauert es mehrere Jahre, bis du von einem neuen Medikament profitieren kannst.
Klinische Studien: Beitrag zur Medizin leisten & neue Behandlung kostenlos erhalten
Du hast wahrscheinlich schon mal von klinischen Studien gehört. Bei so einer Studie werden die Teilnehmer meist in zwei Gruppen aufgeteilt. In einer Gruppe (auch als „Behandlungsarm“ bezeichnet) erhält man das neue Medikament und in der anderen Gruppe eine schon bewährte Behandlung oder ein Placebo. Am Ende werden die Ergebnisse der beiden Gruppen verglichen, um rauszufinden, ob das neue Medikament besser wirkt als der Vergleich. Als Teilnehmer an einer solchen klinischen Studie hast du die Chance, einen wertvollen Beitrag zur Medizin zu leisten und gleichzeitig die neue Behandlung kostenlos zu erhalten.
4 Phasen der Durchführung klinischer Studien für Medikamente
Bei der Durchführung von klinischen Studien gibt es vier verschiedene Phasen, die jedes neue Medikament durchlaufen muss. Diese Phasen sind:
Phase 1: Hier wird das Medikament an einer kleinen Gruppe von gesunden Freiwilligen getestet. Der Zweck ist es, zu sehen, ob es Nebenwirkungen oder unerwünschte Reaktionen gibt.
Phase 2: In dieser Phase wird das Medikament an einer größeren Gruppe von PatientInnen getestet, um mehr Informationen über die Wirksamkeit und die Sicherheit des Medikaments zu erhalten.
Phase 3: In dieser Phase wird das Medikament an einer relativ großen Gruppe von PatientInnen getestet, um weitere Daten über die Wirksamkeit und die Sicherheit des Medikaments zu sammeln.
Phase 4: In dieser Phase wird das Medikament nach der Markteinführung weiterhin beobachtet, um mögliche Nebenwirkungen oder unerwünschte Reaktionen, die erst nach längerer Anwendung aufgetreten sind, zu erkennen.
Durch die Durchführung dieser vier Phasen wird sichergestellt, dass das Medikament vor seiner Einführung auf den Markt alle notwendigen Tests bestanden hat und sicher und wirksam ist. Dadurch können PatientInnen sich sicher sein, dass sie ein Medikament erhalten, das sicher und wirksam ist und bei dem die Nebenwirkungen und unerwünschten Reaktionen gründlich untersucht wurden.
Phase I Klinische Studien am Menschen: Sicherheit & Nebenwirkungen
Klinische Studien am Menschen werden in der Regel in vier Phasen unterteilt, die sogenannten Phase-I-Studien. Sie sind die erste Phase einer klinischen Studie und haben die Aufgabe, die Sicherheit des Verfahrens zu überprüfen. Dazu nehmen meist einige Dutzend Freiwillige an diesen Studien teil. Normalerweise sind dies gesunde Probanden, die sich für die Teilnahme an der Studie entschieden haben. Die Phase-I-Studien sollen herausfinden, wie sich das Medikament oder die Behandlung im Körper verhält, wie es vertragen wird und ob es Nebenwirkungen hat. Dabei wird die Dosierung schrittweise erhöht, bis die maximale verträgliche Dosis ermittelt wurde.
Entwicklung eines Impfstoffs: Ein mehrjähriger Prozess
Der Entwicklungsprozess eines Impfstoffs ist lang und komplex. Es dauert in der Regel mehrere Jahre, bis es zu einer Zulassung kommt. Zuerst müssen die Wissenschaftler den Erreger genau identifizieren und charakterisieren. Anschließend ermitteln sie, welche Teile des Erregers für eine Immunreaktion des Körpers infrage kommen. Dafür werden dann Wirkstoffe im Labor entwickelt und Tests durchgeführt. In diesem Zusammenhang werden auch Studien an Tieren und schließlich auch Menschen durchgeführt, um die Wirksamkeit und Unbedenklichkeit des Impfstoffs zu überprüfen. Erst wenn alle Tests erfolgreich verlaufen, kann das Impfmittel schließlich zugelassen werden.
13 Jahre Entwicklungsprozess: Der Weg zur Zulassung eines Medikaments
Der Weg zur Entwicklung eines neuen Medikaments ist ein sehr langer. Von der Idee bis zur ersten Zulassung dauert es meist mindestens 13 Jahre und auch danach vergehen noch weitere Jahre, bis das Medikament für alle Menschen zugänglich ist, die es benötigen. Im Laufe des Entwicklungsprozesses werden zahlreiche Tests durchgeführt, um festzustellen, ob das Medikament sicher und wirksam ist. Dazu gehören Tierversuche, klinische Studien sowie Tests, bei denen das Medikament an Menschen getestet wird. Wenn alle Tests erfolgreich sind, beantragt der Hersteller die Zulassung des Medikaments bei der zuständigen Behörde. Erst dann kann es den Patienten zur Verfügung gestellt werden. Doch auch danach wird das Medikament ständig überwacht, um sicherzustellen, dass es sicher und wirksam bleibt.
Paul-Ehrlich-Institut: Unterstützung bei Entwicklung von Impfstoff gegen COVID-19
Du hast sicher schon viel über das Paul-Ehrlich-Institut (PEI) gehört, aber wusstest du, dass es eine wichtige Rolle bei der Entwicklung von Impfstoffen spielt? Seit Beginn der COVID-19-Pandemie ist das PEI eine der ersten Adressen, wenn es um die Unterstützung der Impfstoffentwicklung geht. Es ist eines der wenigen Institute, das an europaweiten zentralisierten Zulassungsverfahren beteiligt ist. Experten des PEI arbeiten hier Hand in Hand mit Forschern aus aller Welt, um einen Impfstoff gegen COVID-19 zu entwickeln. Damit tragen sie einen wichtigen Beitrag dazu bei, die Ausbreitung des Virus einzudämmen.
PEI: Zulassung eines Impfstoffs beantragen & unterstützen lassen
Du möchtest einen Impfstoff zulassen lassen? Dann ist das Paul-Ehrlich-Institut (PEI) als zuständige Behörde dafür zuständig. Dazu musst Du einen Zulassungsantrag an das PEI stellen. Dieser muss vollständig ausgefüllt sein, damit die Prüfung des Antrags so schnell wie möglich durchgeführt werden kann. Die Bearbeitungszeit des Antrags hängt von der Komplexität des Antrags ab. Während des Verfahrens kannst Du auch Unterstützung vom PEI bekommen. Das PEI bietet einen Beratungsdienst an, der Dich bei der Beantragung und Durchführung des Verfahrens unterstützt.
Klinische Studien: So werden Medikamente getestet und zugelassen
Du hast schon mal von klinischen Studien gehört? Bei diesen Studien werden Medikamente auf ihre Wirksamkeit untersucht. Zunächst werden die Medikamente bei gesunden Menschen getestet. Diese Phase dauert mindestens ein Jahr, manchmal auch länger. Wenn die Tests erfolgreich verlaufen, kann das Medikament beantragt werden. Im Anschluss wird es an Patienten getestet, um zu sehen, ob es auch in der Praxis wirkt. Die Ergebnisse dieser Tests fließen in die Entscheidung über die Zulassung des Medikaments ein.
Klinische Studien: Vergütung und Risiken erfahren
Du hast vielleicht schon von klinischen Studien gehört, die dazu dienen, neue Medikamente und Behandlungsmethoden zu erforschen. Als Teilnehmer an solchen Studien kannst du eine Vergütung erhalten. Die Vergütung kann mehrere tausend Euro betragen, kann aber auch niedriger ausfallen, je nachdem, wie lange die Studie dauert und welche Aufgaben du als Teilnehmer erfüllst. Wenn die Studie zur Dosisfindung der Phase 2 stationär oder ambulant durchgeführt wird, erhalten Patienten (nur diagnostizierte Patienten) einen Tagessatz von 150 bis 250 Euro.
Allerdings ist das Risiko für Nebenwirkungen relativ hoch, die du durch die Teilnahme an der Studie eingehen musst. Deswegen ist es wichtig, dass du dich vorher über die möglichen Nebenwirkungen informierst. Wenn du dich also für die Teilnahme an einer klinischen Studie entscheidest, ist es sehr wichtig, dass du dir vorher über die möglichen Risiken und Vorteile im Klaren bist.
Sponsoren finanzieren Klinische Studien – Unterstützung für zuverlässige Ergebnisse
Klinische Studien werden oft von verschiedenen Arten von Sponsoren finanziert. Zu den häufigsten zählen Pharmaunternehmen, Regierungen, gemeinnützige Forschungsorganisationen, Stiftungen, Krankenhäuser oder Heilanstalten und gemeinnützige Verbände wie Patientenverbände. Diese Sponsoren stellen ihre finanziellen Ressourcen bereit, um die Kosten für die Durchführung der Studie zu tragen. Darüber hinaus können sie auch Mitarbeiter bereitstellen, um die Studie vor Ort zu betreuen, und sie können auch einige der Forschungsausrüstungen beisteuern. Diese Unterstützung ist sehr wichtig, um sicherzustellen, dass die Studie nach den höchsten Standards durchgeführt wird. So können wir sicher sein, dass die Studienergebnisse zuverlässig und wissenschaftlich fundiert sind.
Klinische Prüfungen vor Markteinführung von Arzneimitteln
Du hast bestimmt schon mal von klinischen Prüfungen gehört. Bevor ein Arzneimittel auf den Markt kommt, muss es vorher eine solche Prüfung durchlaufen. Seit 2004 ist das in Deutschland auch gesetzlich vorgeschrieben. Je nach Arzneimittel wird die Prüfung dann von der Bundesoberbehörde BfArM (Bundesinstitut für Arzneimittel und Medizinprodukte) oder PEI (Paul-Ehrlich-Institut) durchgeführt. Diese muss dann auch entscheiden, ob das Arzneimittel auf den Markt kommen darf oder nicht.
Labor- und Tierstudien: Sicherheit von Arzneimitteln bestimmen
Nein, am Menschen erfolgt keine Prüfung, aber es gibt andere Methoden, um die Sicherheit eines Arzneimittels zu bestimten. Dazu gehören Laborstudien und Studien an Tieren. Diese Studien sind für alle Medikamente unerlässlich, bevor sie an Menschen verabreicht werden. So können mögliche Nebenwirkungen aufgedeckt und das Risiko für Menschen bewertet werden. Laborstudien untersuchen die Wirkstoffe und ihre Wirkung auf Zellen und Gewebe. Studien an Tieren gehen noch einen Schritt weiter und erforschen die Auswirkungen des Arzneimittels auf das Verhalten und die körperliche Gesundheit. So kann das Risiko für mögliche Nebenwirkungen bei Menschen eingeschätzt werden. Mit der Kombination dieser beiden Methoden kann die Sicherheit eines Arzneimittels bestimmt werden.
Powerberechnung: 17 Probanden pro Gruppe für 80% Power
Du hast ein wissenschaftliches Experiment geplant und möchtest wissen, wie viele Probanden du für eine bestimmte Power benötigst? Wenn die Standardabweichung bei 5 mm Hg liegt, dann musst du 17 Probanden pro Gruppe haben, um eine Power von 80 % zu erreichen. Aber wenn die Abweichung größer als erwartet ist, z. B. 6 mm Hg, dann sinkt die Power auf 65 %. Um wieder auf eine Power von 80 % zu kommen, musst du mehr Probanden haben, nämlich 24 pro Gruppe.
Klinische Studie: Profitiere früh von neuen Therapien und verbesser deine medizinische Versorgung
Du hast dir vorgenommen, deine medizinische Versorgung zu verbessern? Dann könnte eine Teilnahme an einer klinischen Studie eine gute Option für dich sein! Mit deiner Teilnahme erhältst du nicht nur die Chance, früher als andere von innovativen Therapien zu profitieren, sondern du trägst auch zur Entwicklung moderner medizinischer Verfahren bei. Doch keine Sorge – die Sicherheit steht dabei an erster Stelle. Die Regularien der Studie sorgen dafür, dass du gut abgesichert bist und du kannst jederzeit entscheiden, ob du weiter an der Studie teilnehmen möchtest oder nicht. Alles in allem ist die Teilnahme an klinischen Studien freiwillig und kann deine medizinische Versorgung verbessern.
Warum unser Vertrauen in klinische Studien gerechtfertigt ist
Du hast vielleicht schon einmal gehört, dass klinische Studien keine absoluten Wahrheiten liefern. Aber hast du dir schon einmal überlegt, warum das so ist? Die Ergebnisse klinischer Studien sind das Resultat statistischer Analysen. Diese Analysen werden in aller Regel so konzipiert, dass ihre Ergebnisse nur mit einer sehr geringen Wahrscheinlichkeit, nämlich weniger als fünf Prozent, zufällig sind. Dies bedeutet, dass die Ergebnisse einer klinischen Studie bei einer Wiederholung nahezu identisch sein würden. Auf diese Weise können die Forscher sicherstellen, dass ihre Ergebnisse nicht aufgrund von Zufällen oder Glück erzielt wurden, sondern dass sie aufgrund der Forschungsergebnisse gesichert sind.
Nuvaxovid-Impfstoff: 79,3% weniger Risiko für Covid-19-Erkrankungen
Am Ende der Zulassung von Nuvaxovid lagen Daten für die primäre Wirksamkeitsanalyse von rund 17.000 Geimpften vor – eine Zahl, die auf einer Grundgesamtheit von 25.000 Teilnehmern beruht. Mit den Daten konnte nachgewiesen werden, dass sich das Risiko einer symptomatischen Covid-19-Erkrankung durch den Einsatz des Impfstoffs um 79,3 Prozent reduzieren lässt. Durch die Impfung konnten somit schwere Verläufe und Komplikationen verhindert werden.
Jedes Jahr an mehreren Studien teilnehmen
Du fragst Dich, wie oft Du an einer Studie teilnehmen kannst? Wir können Dir versichern, dass Du jedes Jahr an mehreren Studien teilnehmen kannst. Nach jeder Studie, also an dem Tag der Nachuntersuchung, beginnt für Dich eine Sperrfrist von ungefähr zwei bis drei Monaten. In dieser Zeit darfst Du leider nicht an weiteren Studien teilnehmen. Sobald die Sperrfrist vorüber ist, kannst Du Dich wieder für eine Studie bewerben. Also nutze Deine Chance und profitiere von den Vorteilen als Studienteilnehmer!
Schlussworte
Klinische Studien zur Entwicklung eines Impfstoffes dauern in der Regel mindestens ein bis zwei Jahre, bevor ein Impfstoff auf den Markt kommen kann. Dazu müssen mehrere Tests und Studien durchgeführt werden, die sicherstellen, dass der Impfstoff sicher und wirksam ist. In bestimmten Fällen kann die Entwicklung eines Impfstoffes auch länger dauern.
Zusammenfassend kann man sagen, dass klinische Studien für Impfstoffe eine sehr komplexe und langwierige Aufgabe darstellen. Sie können Monate oder sogar Jahre in Anspruch nehmen, je nachdem, wie aufwändig sie sind. Du solltest also Geduld haben, wenn Du auf das Ergebnis einer klinischen Studie wartest.